核准日期:2007年04月10日
注射用更昔洛韦钠说明书
请仔细阅读说明书并在医师指导下使用。
【药品名称】
通用名称:注射用更昔洛韦钠
商品名称:林可宏
英文名称:Ganciclovir Sodium for Injection
汉语拼音:Zhusheyong Gengxiluoweina
【成份】
本品成份为更昔洛韦钠。
化学名称为:9-(1,3-二羟基-2-丙氧甲基)-鸟嘌呤单钠盐。
化学结构式:
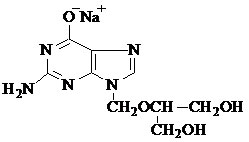 分子式:C9H12N5NaO4
分子式:C9H12N5NaO4
分子量:277.22
通用名称:注射用更昔洛韦钠
商品名称:林可宏
英文名称:Ganciclovir Sodium for Injection
汉语拼音:Zhusheyong Gengxiluoweina
【成份】
本品成份为更昔洛韦钠。
化学名称为:9-(1,3-二羟基-2-丙氧甲基)-鸟嘌呤单钠盐。
化学结构式:

分子量:277.22
【性状】
本品为白色或类白色的疏松块状物或粉末。
【适应症】
仅用于:
1.免疫功能缺陷者(包括艾滋病患者)发生的巨细胞病毒性视网膜炎。
2.预防可能发生于接受器官移植者的巨细胞病毒感染。
【规格】
按C9H13N5O4计算 (1)0.25g ; (2)0.5g
【用法用量】
1.治疗巨细胞病毒感染性视网膜炎。肾功能正常者诱导期:静脉滴注,每次5mg/kg,一日2次,连用14~21天。维持期:静脉滴注,每次5mg/kg,为一日1次,连用7天,或一次6mg/kg,一日1次,连用5天维持治疗。每次静脉滴注时间不少于1小时。肾功能异常者参照下表(表1),或遵医嘱。
2.预防可能发生于接受器官移植者的巨细胞病毒感染:
肾功能正常者:静脉滴注,一次5mg/kg,每12小时一次,连用7天~14天后,改为一次5mg/kg,一日1次,一周用7天,或一次6mg/kg,一日1次,每周用5天,或遵医嘱。每次静脉滴注时间不少于1小时。
肾功能损伤者:根据肌酐清除率酌情调整用量,具体见下表(表1)
表1、肾功能损害者用药参考
本品静脉滴注时,配置方法如下:首先根据患者体重确定使用剂量,用适量注射用水或生理盐水使之溶解,浓度达50mg/ml,再注入0.9%氯化钠溶液、5% 葡萄糖溶液、林格氏液或乳酸林格氏液100ml中静脉缓慢滴注,滴注液浓度不得大于10mg/ml。
【不良反应】
较易发生粒细胞减少症、贫血症或血小板减少症。尚可见:视网膜脱落、头痛、头昏、呼吸困难、恶心、呕吐、腹疼、腹泻、厌食、消化道出血、心律失常、血压升高或血压下降、寒战、血尿、血尿素氮增加、脱发、瘙痒、荨麻疹、血糖降低、浮肿、周身不适、肌酐增加、嗜睡等。
【禁忌】
对本品或阿昔洛韦过敏者禁用。
【注意事项】
1.一次最大剂量为6mg/kg,充分溶解后,缓慢静滴。溶液呈强碱性,故滴注时间不得少于1小时,避免与皮肤、粘膜接触,避免液体渗漏到血管外组织。
2.白细胞计数低于500/mm3 或血小板计数低于25,000/mm3 患者慎用。
3.肾功能损害患者慎用。
【孕妇及哺乳期妇女用药】
本品治疗剂量下可引起胎儿畸形,没有进行孕妇用药安全性对照性研究,孕妇只有在获益大于胎儿致畸风险时使用。尚不清楚本品是否经乳汁分泌,哺乳期妇女用药时,应停止哺乳。
【儿童用药】
儿童用药的安全性及有效性尚未确立。只有在利害评估获益大于风险时使用。
【老年用药】
老年人用药无特殊。如肾功能减退应酌情使用。
【药物相互作用】
影响造血系统的药物、骨髓抑制剂及放射治疗等与本品同用时,可增加对骨髓的抑制作用。
去羟肌苷:更昔洛韦与去羟肌苷合用,稳态时去羟肌苷AUC0-12 增加111±114%,更昔洛韦AUC减少21±17%,但AUC不受去羟肌苷的影响。
齐多夫定:更昔洛韦与齐多夫定合用,稳态时齐多夫定AUC0-4 增加19±27%,更昔洛韦AUC0-8 下降17±25%,两者均有潜在的神经毒性和引起贫血的可能,合用时不宜全量给予。
丙磺舒:更昔洛韦与丙磺舒合用时,其肾清除率下降。
亚胺培南-西司他丁:更昔洛韦与之合用时有引起癫痫发作的可能,避免同时使用。
抑制高分裂相细胞(骨髓、精原细胞、皮肤和胃肠道粘膜生发层)复制的药物(氨苯砜、喷他脒、氟胞嘧啶、长春新碱、长春花碱、阿霉素、两性霉素B、甲氧苄啶/磺胺恶唑或其他核苷类)与更昔洛韦合用时毒性增加。合用时应权衡利弊。
有文献报道更昔洛韦注射液与已知有神经毒性药物环孢毒素或两性霉素B使用时,血清肌酐增加。
【药物过量】
文献报道:1例合并巨细胞病毒性结肠炎的成年艾滋病患者,高剂量使用该品(每天3000mg)2天后,出现严重的不可逆性全血细胞减少,继而发展为恶性消化道症状和急性肾功能衰竭而不得不进行血液透析,最终死于恶液质。其他过量的不良反应包括持续性骨髓抑制、不可逆性中性粒细胞减少、肝炎、肾毒性、肌酐升高、癫痫发作。一例成年患者玻璃体内过量注射后引起短暂视觉丧失和视网膜中心动脉闭塞。
血液透析有利于降低更昔洛韦血清浓度,应充分水化。酌情使用造血生长因子。
【药理毒理】
药理作用
本品为一种2-脱氧鸟嘌呤核苷酸的类似物,可抑制疱疹病毒的复制,其作用机理是:更昔洛韦首先被巨细胞病毒CMV编码(UL97基因)的蛋白激酶同系物磷酸化成单磷酸盐,再通过细胞激酶进一步磷酸化成二磷酸盐和三磷酸盐。在CMV感染的细胞内,三磷酸盐的水平比非感染细胞中的水平高100倍,提示本品在感染的细胞中可优先磷酸化。更昔洛韦一旦形成三磷酸盐,能在CMV感染的细胞内持续数天。更昔洛韦的三磷酸盐被认为能通过以下方式抑制病毒的DNA合成:1)竞争性地抑制病毒DNA聚合酶;2)共同进入病毒DNA内,从而导致病毒DNA延长的终止。
临床已证实,本品对巨细胞病毒(CMV)和单纯疱疹病毒(HSV)所致感染有效。
毒理作用
遗传毒性:
更昔洛韦浓度分别为50-500g/ml及250-2000g/ml 时,体外可增加小鼠淋巴瘤细胞的突变和人淋巴细胞DNA的损伤。在小鼠微核试验中,更昔洛韦在150mg和500mg/kg(iv)(以AUC计算,相当于人暴露量的2.8至10倍)时,有致裂变作用,但在50mg/kg(以AUC计算,与人用药剂量相当)时无此作用。Ames沙门氏菌试验表明,更昔洛韦在500-5000g/ml浓度下,无致突变作用。
生殖毒性:
雌性小鼠静脉给予更昔洛韦90mg/kg/日(以AUC计算,约相当于人给药剂量为5mg/kg平均暴露水平时的1.7倍),可引起交配行为减少,生育力降低,并增加胚胎死亡率。每日口服或静脉给予本品剂量范围在0.2-10mg/kg时, 可引起雄性小鼠生育力下降,并降低小鼠和狗的生精能力。不同种族动物显示毒性反应的最低剂量下AUC范围为推荐人静脉剂量下AUC的0.03-0.1倍。
更昔洛韦静脉给药,对家兔和小鼠显示有胚胎毒性,并对家兔有致畸作用。在给药剂量分别为60mg/kg/日及108mg/kg/日 (相当于人的2倍AUC)下,至少85%的家兔和小鼠出现胚胎重吸收。在家兔观察到的作用包括:胚胎生长迟缓、胚胎死亡、致畸和/或母体毒性。致畸作用包括 :上颚裂、无眼畸形或小眼畸形、器官发育不全(肾和胰腺)、脑积水及短颌。在小鼠可观察到母体/胚胎毒性和胚胎死亡。
雌性小鼠在交配前、孕期和授乳期,每日静脉给予90mg/kg,可引起达1月龄的雄性动物后代睾丸及精囊发育不全,以及胃的非腺体区病理改变。以AUC计算,小鼠的暴露剂量约相当于人AUC的1.7倍。
更昔洛韦在人用的推荐剂量水平,可能引起致畸和胚胎毒性。没有对妊娠妇女进行充分的、严格对照的研究,故只有在充分显示治疗益处超过对胎儿的潜在危害时,方可在妊娠期使用本品。
对更昔洛韦是否分泌入人类乳汁的情况尚不清楚。但是,由于许多药物可分泌入人乳,且更昔洛韦治疗可引起动物致癌和致畸,所以应当考虑哺乳妇女在接受治疗时停止授乳。
致癌性:
小鼠经口给予更昔洛韦剂量为 20和1000mg/kg/ 日时,有致癌作用(以AUC计算,分别约相当于人静脉给予推荐剂量5mg/kg/日的0.1和1.4倍)。当剂量为1000mg/kg/日时,显著增加雄性小鼠包皮腺、雌性和雄性小鼠前胃(非腺性粘膜)、雌性小鼠生殖组织(卵巢、子宫、乳腺、阴蒂腺和阴道)及肝脏的肿瘤发生率。当剂量为20mg/kg/日时,轻度增加雄性小鼠包皮腺和副泪腺、雄性和雌性小鼠的前胃和雌性小鼠肝脏的肿瘤发生率。当小鼠服用更昔洛韦剂量为1mg/kg/日(以AUC计算,相当于人用剂量的0.01倍)时,未观察到致癌作用。除肝脏的组织细胞肉瘤,更昔洛韦引起的肿瘤一般为上皮或血管源性。虽然小鼠的包皮腺、阴蒂腺、前胃及副泪腺在人类没有相应的组织部位,但应考虑更昔洛韦对人体有潜在的致癌作用。
【药代动力学】
据PDR56版:
吸收:空腹口服更昔洛韦的绝对生物利用度约为5%,餐后为6%至9%。持续静脉滴注(1小时)更昔洛韦(5mg/kg)后, AUC为22.1±3.2 g•hr/ml至26.8±6.1 g•hr/ml,Cmax范围在8.27±1.02 g•hr/ml 至9.0±1.4 g/ml。
分布:静脉注射更昔洛韦后其稳态分布容积为0.74±0.15 L/kg。脑脊液中浓度为同期血药浓度的7%~67%。在为0.5至51 g/ml血药浓度范围内,血浆蛋白结合率为1%至2%。
代谢:本品几乎体内不代谢。
清除:更昔洛韦静脉滴注,在1.6~5.0mg/kg剂量范围内呈线性关系。91.3±5.0%的药物以原形经肾小球滤过和肾小管主动分泌排出,肌酐清除率(Cr)为3.20±0.80ml/min/kg时,该品清除率为3.52±0.80ml/min/kg。半衰期为3.5±0.9小时。
特殊人群:
肾功能不全者:血浆半衰期不同程度地延长。轻度肾功能损害者(肌酐清除率50~70ml/min/1.73m2 ),总清除率为128±63ml/min/1.73m2 ,血浆半衰期为4.6±1.4小时;中度肾功能损害者(肌酐清除率25~49ml/min/1.73mm2 ),总清除率为57±8ml/min/1.73m2 ,血浆半衰期为4.4±0.4小时;重度肾功能损害者(肌酐清除率小于25ml/min/1.73m2 ),总清除率为30±13ml/min/1.73m2 ,血浆半衰期为10.7±5.7小时。总清除率与肌酐清除率有肯定的相关性。对严重肾功能损害者而言,血液透析可降低血药浓度约5%。
种族:黑色人种和西班牙裔稳态时的Cmax 和AUC0-8 有低于高加索人的趋势。
性别:没有显著差异。
儿童:静脉注射的药代动力学和成人基本一致。
老年人:65岁以上老年人无药代动力学资料。
【贮 藏】 遮光密闭,在阴凉(不超过20℃)处保存。
【包 装】管制注射剂瓶。(1)0.25g:1瓶/盒,6瓶/盒,10瓶/盒;(2)0.5g: 1瓶/盒,6瓶/盒。
【有 效 期】24个月。
【执行标准】 国家食品药品监督管理局标准(试行)YBH01842005。
【批准文号】 (1) 0.25g: 国药准字H20050156
(2) 0.5g: 国药准字H20050157
【生产企业】
企业名称:南京海辰药业股份有限公司
生产地址:南京经济技术开发区恒发路1号
邮政编码:210046
电话号码:025-83240017
传真号码:025-83248900
网 址:www.hicin.cn
本品为白色或类白色的疏松块状物或粉末。
【适应症】
仅用于:
1.免疫功能缺陷者(包括艾滋病患者)发生的巨细胞病毒性视网膜炎。
2.预防可能发生于接受器官移植者的巨细胞病毒感染。
【规格】
按C9H13N5O4计算 (1)0.25g ; (2)0.5g
【用法用量】
1.治疗巨细胞病毒感染性视网膜炎。肾功能正常者诱导期:静脉滴注,每次5mg/kg,一日2次,连用14~21天。维持期:静脉滴注,每次5mg/kg,为一日1次,连用7天,或一次6mg/kg,一日1次,连用5天维持治疗。每次静脉滴注时间不少于1小时。肾功能异常者参照下表(表1),或遵医嘱。
2.预防可能发生于接受器官移植者的巨细胞病毒感染:
肾功能正常者:静脉滴注,一次5mg/kg,每12小时一次,连用7天~14天后,改为一次5mg/kg,一日1次,一周用7天,或一次6mg/kg,一日1次,每周用5天,或遵医嘱。每次静脉滴注时间不少于1小时。
肾功能损伤者:根据肌酐清除率酌情调整用量,具体见下表(表1)
表1、肾功能损害者用药参考
| 用量 | 诱导期 | 维持期 | ||
| 肌酐清除率(mL/min) | 剂量 (mg/kg) | 间隔时间(h) | 剂量(mg/kg) | 间隔时间(h) |
| ≥70 | 5.0 | 12 | 5.0 | 24 |
| 50~69 | 2.5 | 12 | 2.5 | 24 |
| 25~49 | 2.5 | 24 | 1.25 | 24 |
| 10~24 | 1.25 | 24 | 0.625 | 24 |
| <10 | 1.25 | 血液透析后使用,3次/周 | 0.625 | 血液透析后使用,3次/周 |
【不良反应】
较易发生粒细胞减少症、贫血症或血小板减少症。尚可见:视网膜脱落、头痛、头昏、呼吸困难、恶心、呕吐、腹疼、腹泻、厌食、消化道出血、心律失常、血压升高或血压下降、寒战、血尿、血尿素氮增加、脱发、瘙痒、荨麻疹、血糖降低、浮肿、周身不适、肌酐增加、嗜睡等。
【禁忌】
对本品或阿昔洛韦过敏者禁用。
【注意事项】
1.一次最大剂量为6mg/kg,充分溶解后,缓慢静滴。溶液呈强碱性,故滴注时间不得少于1小时,避免与皮肤、粘膜接触,避免液体渗漏到血管外组织。
2.白细胞计数低于500/mm3 或血小板计数低于25,000/mm3 患者慎用。
3.肾功能损害患者慎用。
【孕妇及哺乳期妇女用药】
本品治疗剂量下可引起胎儿畸形,没有进行孕妇用药安全性对照性研究,孕妇只有在获益大于胎儿致畸风险时使用。尚不清楚本品是否经乳汁分泌,哺乳期妇女用药时,应停止哺乳。
【儿童用药】
儿童用药的安全性及有效性尚未确立。只有在利害评估获益大于风险时使用。
【老年用药】
老年人用药无特殊。如肾功能减退应酌情使用。
【药物相互作用】
影响造血系统的药物、骨髓抑制剂及放射治疗等与本品同用时,可增加对骨髓的抑制作用。
去羟肌苷:更昔洛韦与去羟肌苷合用,稳态时去羟肌苷AUC0-12 增加111±114%,更昔洛韦AUC减少21±17%,但AUC不受去羟肌苷的影响。
齐多夫定:更昔洛韦与齐多夫定合用,稳态时齐多夫定AUC0-4 增加19±27%,更昔洛韦AUC0-8 下降17±25%,两者均有潜在的神经毒性和引起贫血的可能,合用时不宜全量给予。
丙磺舒:更昔洛韦与丙磺舒合用时,其肾清除率下降。
亚胺培南-西司他丁:更昔洛韦与之合用时有引起癫痫发作的可能,避免同时使用。
抑制高分裂相细胞(骨髓、精原细胞、皮肤和胃肠道粘膜生发层)复制的药物(氨苯砜、喷他脒、氟胞嘧啶、长春新碱、长春花碱、阿霉素、两性霉素B、甲氧苄啶/磺胺恶唑或其他核苷类)与更昔洛韦合用时毒性增加。合用时应权衡利弊。
有文献报道更昔洛韦注射液与已知有神经毒性药物环孢毒素或两性霉素B使用时,血清肌酐增加。
【药物过量】
文献报道:1例合并巨细胞病毒性结肠炎的成年艾滋病患者,高剂量使用该品(每天3000mg)2天后,出现严重的不可逆性全血细胞减少,继而发展为恶性消化道症状和急性肾功能衰竭而不得不进行血液透析,最终死于恶液质。其他过量的不良反应包括持续性骨髓抑制、不可逆性中性粒细胞减少、肝炎、肾毒性、肌酐升高、癫痫发作。一例成年患者玻璃体内过量注射后引起短暂视觉丧失和视网膜中心动脉闭塞。
血液透析有利于降低更昔洛韦血清浓度,应充分水化。酌情使用造血生长因子。
【药理毒理】
药理作用
本品为一种2-脱氧鸟嘌呤核苷酸的类似物,可抑制疱疹病毒的复制,其作用机理是:更昔洛韦首先被巨细胞病毒CMV编码(UL97基因)的蛋白激酶同系物磷酸化成单磷酸盐,再通过细胞激酶进一步磷酸化成二磷酸盐和三磷酸盐。在CMV感染的细胞内,三磷酸盐的水平比非感染细胞中的水平高100倍,提示本品在感染的细胞中可优先磷酸化。更昔洛韦一旦形成三磷酸盐,能在CMV感染的细胞内持续数天。更昔洛韦的三磷酸盐被认为能通过以下方式抑制病毒的DNA合成:1)竞争性地抑制病毒DNA聚合酶;2)共同进入病毒DNA内,从而导致病毒DNA延长的终止。
临床已证实,本品对巨细胞病毒(CMV)和单纯疱疹病毒(HSV)所致感染有效。
毒理作用
遗传毒性:
更昔洛韦浓度分别为50-500g/ml及250-2000g/ml 时,体外可增加小鼠淋巴瘤细胞的突变和人淋巴细胞DNA的损伤。在小鼠微核试验中,更昔洛韦在150mg和500mg/kg(iv)(以AUC计算,相当于人暴露量的2.8至10倍)时,有致裂变作用,但在50mg/kg(以AUC计算,与人用药剂量相当)时无此作用。Ames沙门氏菌试验表明,更昔洛韦在500-5000g/ml浓度下,无致突变作用。
生殖毒性:
雌性小鼠静脉给予更昔洛韦90mg/kg/日(以AUC计算,约相当于人给药剂量为5mg/kg平均暴露水平时的1.7倍),可引起交配行为减少,生育力降低,并增加胚胎死亡率。每日口服或静脉给予本品剂量范围在0.2-10mg/kg时, 可引起雄性小鼠生育力下降,并降低小鼠和狗的生精能力。不同种族动物显示毒性反应的最低剂量下AUC范围为推荐人静脉剂量下AUC的0.03-0.1倍。
更昔洛韦静脉给药,对家兔和小鼠显示有胚胎毒性,并对家兔有致畸作用。在给药剂量分别为60mg/kg/日及108mg/kg/日 (相当于人的2倍AUC)下,至少85%的家兔和小鼠出现胚胎重吸收。在家兔观察到的作用包括:胚胎生长迟缓、胚胎死亡、致畸和/或母体毒性。致畸作用包括 :上颚裂、无眼畸形或小眼畸形、器官发育不全(肾和胰腺)、脑积水及短颌。在小鼠可观察到母体/胚胎毒性和胚胎死亡。
雌性小鼠在交配前、孕期和授乳期,每日静脉给予90mg/kg,可引起达1月龄的雄性动物后代睾丸及精囊发育不全,以及胃的非腺体区病理改变。以AUC计算,小鼠的暴露剂量约相当于人AUC的1.7倍。
更昔洛韦在人用的推荐剂量水平,可能引起致畸和胚胎毒性。没有对妊娠妇女进行充分的、严格对照的研究,故只有在充分显示治疗益处超过对胎儿的潜在危害时,方可在妊娠期使用本品。
对更昔洛韦是否分泌入人类乳汁的情况尚不清楚。但是,由于许多药物可分泌入人乳,且更昔洛韦治疗可引起动物致癌和致畸,所以应当考虑哺乳妇女在接受治疗时停止授乳。
致癌性:
小鼠经口给予更昔洛韦剂量为 20和1000mg/kg/ 日时,有致癌作用(以AUC计算,分别约相当于人静脉给予推荐剂量5mg/kg/日的0.1和1.4倍)。当剂量为1000mg/kg/日时,显著增加雄性小鼠包皮腺、雌性和雄性小鼠前胃(非腺性粘膜)、雌性小鼠生殖组织(卵巢、子宫、乳腺、阴蒂腺和阴道)及肝脏的肿瘤发生率。当剂量为20mg/kg/日时,轻度增加雄性小鼠包皮腺和副泪腺、雄性和雌性小鼠的前胃和雌性小鼠肝脏的肿瘤发生率。当小鼠服用更昔洛韦剂量为1mg/kg/日(以AUC计算,相当于人用剂量的0.01倍)时,未观察到致癌作用。除肝脏的组织细胞肉瘤,更昔洛韦引起的肿瘤一般为上皮或血管源性。虽然小鼠的包皮腺、阴蒂腺、前胃及副泪腺在人类没有相应的组织部位,但应考虑更昔洛韦对人体有潜在的致癌作用。
【药代动力学】
据PDR56版:
吸收:空腹口服更昔洛韦的绝对生物利用度约为5%,餐后为6%至9%。持续静脉滴注(1小时)更昔洛韦(5mg/kg)后, AUC为22.1±3.2 g•hr/ml至26.8±6.1 g•hr/ml,Cmax范围在8.27±1.02 g•hr/ml 至9.0±1.4 g/ml。
分布:静脉注射更昔洛韦后其稳态分布容积为0.74±0.15 L/kg。脑脊液中浓度为同期血药浓度的7%~67%。在为0.5至51 g/ml血药浓度范围内,血浆蛋白结合率为1%至2%。
代谢:本品几乎体内不代谢。
清除:更昔洛韦静脉滴注,在1.6~5.0mg/kg剂量范围内呈线性关系。91.3±5.0%的药物以原形经肾小球滤过和肾小管主动分泌排出,肌酐清除率(Cr)为3.20±0.80ml/min/kg时,该品清除率为3.52±0.80ml/min/kg。半衰期为3.5±0.9小时。
特殊人群:
肾功能不全者:血浆半衰期不同程度地延长。轻度肾功能损害者(肌酐清除率50~70ml/min/1.73m2 ),总清除率为128±63ml/min/1.73m2 ,血浆半衰期为4.6±1.4小时;中度肾功能损害者(肌酐清除率25~49ml/min/1.73mm2 ),总清除率为57±8ml/min/1.73m2 ,血浆半衰期为4.4±0.4小时;重度肾功能损害者(肌酐清除率小于25ml/min/1.73m2 ),总清除率为30±13ml/min/1.73m2 ,血浆半衰期为10.7±5.7小时。总清除率与肌酐清除率有肯定的相关性。对严重肾功能损害者而言,血液透析可降低血药浓度约5%。
种族:黑色人种和西班牙裔稳态时的Cmax 和AUC0-8 有低于高加索人的趋势。
性别:没有显著差异。
儿童:静脉注射的药代动力学和成人基本一致。
老年人:65岁以上老年人无药代动力学资料。
【贮 藏】 遮光密闭,在阴凉(不超过20℃)处保存。
【包 装】管制注射剂瓶。(1)0.25g:1瓶/盒,6瓶/盒,10瓶/盒;(2)0.5g: 1瓶/盒,6瓶/盒。
【有 效 期】24个月。
【执行标准】 国家食品药品监督管理局标准(试行)YBH01842005。
【批准文号】 (1) 0.25g: 国药准字H20050156
(2) 0.5g: 国药准字H20050157
【生产企业】
企业名称:南京海辰药业股份有限公司
生产地址:南京经济技术开发区恒发路1号
邮政编码:210046
电话号码:025-83240017
传真号码:025-83248900
网 址:www.hicin.cn



 86-25-85570680
86-25-85570680